药物/医疗器械临床试验质量管理规范培训
——暨临床试验技能提高培训班
第三轮通知
中国.上海 2019.11.16
各药物临床试验机构、临床试验伦理委员会及相关单位:
为紧跟我国临床试验质量管理规范的发展步伐,帮助研究单位及医疗机构以及临床研究人员更好的理解和掌握临床试验相关法规和临床试验操作的技巧。解答在开展临床试验时遇到诸多技术层面的实际问题,进一步提升对药物临床试验的质量与安全的掌控能力,科学、严谨地组织好临床试验的研究工作,切实提高科研能力和管理水平,更好的为“人民用药安全”这一目标服务。为此,拟于2019年11月16日在上海举办“药物/医疗器械临床试验质量管理规范培训班”。
本次培训将邀请我国临床试验相关领域的资深专家,围绕例如:新药品管理法对临床试验的影响、药物临床试验科学设计与可操作性之间关键要素、人类遗传办公室的备案和申请、创新药物的伦理审查等内容给予学员们现场指导,并为大家解惑和讨论临床工作中遇到的实际问题。本次培训由中国药理学会药物临床试验专业委员会主办,上海市药理学会药物临床试验专业委员会和复旦大学附属中山医院承办。
一、 参会对象
医疗机构临床试验机构及伦理委员会的成员;
医疗机构从事临床试验的医生、护士及相关人员;
制药企业的药物临床研究部门、质量管理部门的团队成员;
CRO公司、SMO公司、高校及科研院所等单位的项目团队成员;
二、 培训日程
报到时间:2019年11月16日(07:30~08:30)
培训地点:复旦大学上海医学院东区明道楼2楼报告厅
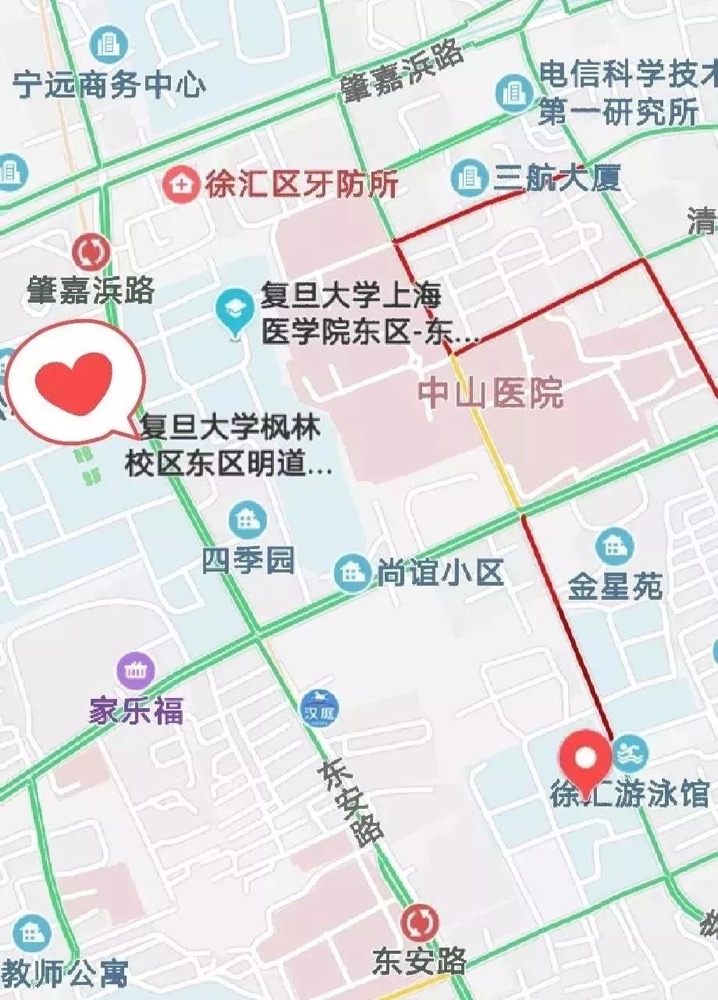
培训地址:上海市徐汇区东安路131号(复旦大学上海医学院东区内)
培训时间:2019年11月16日(08:30~12:00 / 13:00~16:30)
三、 培训内容
1.临床试验相关法规--药品管理法的新要求
2.临床试验向人类遗传办公室备案和申请的要素
3.迎接挑战,如何做好创新药的伦理审查
4.医疗器械临床试验中不良事件和产品缺陷的报告与管理
5. 药物临床试验方案设计关注点
6. 药物临床试验安全性事件的管理
7. 研究者在药物和医疗器械临床试验中的职责
四、 培训证书
参加全程学习并通过结业考试的学员将获得“药物/医疗器械临床试验质量管理规范培训暨临床试验技能提高培训”证书。
五、 培训费用
1.11月12日之前报名:800元/人
2.11月12日之后及现场报名:1000元/人;
3.培训期间提供11月16日的午餐,学员的住宿、交通及其他餐饮费用自理。
六、 缴纳方式
1.银行汇款;
2.现场报到时通过刷卡、支付宝转账或现金缴纳;
3. 培训汇款账户, 会务组在培训结束后10个工作日内寄送证书和“培训费”发票:
|
户 名:上海市药理学会 |
|
开户行:农行上海翔殷支行 |
|
账 号:03326708017037238 备注:汇款请以“11月16日-GCP培训(上海)+单位+姓名”的格式填写备注。 |
七、 报名方式
请在报名回执中填写好参加培训人员信息,填好回执后请发送到:
报名邮箱 E-mail:chinadctc@126.com
联系人:
会务组:李裕(13962165602)
中国药理学会药物临床试验专业委员会
上海市药理学会药物临床试验专业委员会
复旦大学附属中山医院临床试验机构
2019年10月31日



 微信
微信

 高级网站搜索
高级网站搜索